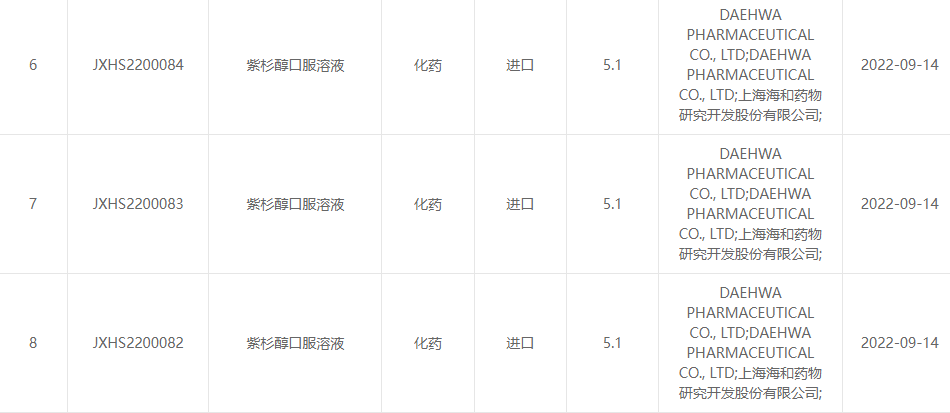
Am 13. September 2022 gaben Shanghai Haihe Pharmaceutical Research and Development Co., Ltd. und Daehwa Pharmaceutical Co., Ltd. gemeinsam bekannt, dass die von beiden Parteien gemeinsam entwickelte orale Paclitaxel-Lösung (RMX3001) offiziell vom Center for Drug zugelassen wurde Evaluation (CDE) der State Drug Administration.(Annahmenummer: JXHS2200082 Land, JXHS2200083 Land, JXHS2200084 Land).
Bildquelle: State Drug Administration
Paclitaxelwird häufig bei der Behandlung verschiedener bösartiger Tumoren wie Lungenkrebs, Brustkrebs, Eierstockkrebs, Kopf- und Halskrebs und Magenkrebs eingesetzt.Proteinpolymerisation, Zusammenbau von Mikrotubuli, Verhinderung der Depolymerisation, Stabilisierung der Mikrotubuli, Hemmung der Mitose von Krebszellen und Auslösung der Apoptose, wodurch die Proliferation von Krebszellen wirksam verhindert und eine krebshemmende Wirkung erzielt wird.
Derzeit wird Paclitaxel in den meisten Teilen der Welt in Form einer Injektion verwendet, die im Krankenhaus formuliert und über eine intravenöse Infusion verabreicht werden muss.Patienten müssen häufig ins Krankenhaus zurückkehren und es kommt zu Nebenwirkungen an der Injektionsstelle.Daher war die Entwicklung oraler Paclitaxel-Präparate schon immer ein Schwerpunkt der Industrieforschung..
RMX3001 ist eine orale Formulierung von Paclitaxel, die von Dahua Pharmaceutical auf der Grundlage seiner innovativen selbstemulgierenden Lipid-Arzneimittelverabreichungstechnologie entwickelt wurde.Es wurde im September 2016 von der koreanischen Lebensmittel- und Arzneimittelbehörde zugelassen (Handelsname Liporaxel) und die Indikation ist die fortgeschrittene oder Zweitlinienbehandlung von metastasiertem Magenkrebs oder lokal rezidivierendem Magenkrebs.Laut einer Pressemitteilung von Haihe Pharmaceuticals ist Liporaxel das erste orale Paclitaxel-Produkt, das bislang weltweit erfolgreich entwickelt und für die Vermarktung zugelassen wurde.Im September 2017 erhielt Haihe Pharmaceutical von Dahua Pharmaceuticals die F&E-, Produktions- und Vertriebsrechte des Produkts auf dem chinesischen Festland, in Hongkong, Taiwan und Thailand.
Der Zulassungsantrag von RMX3001 in China basiert hauptsächlich auf einer randomisierten, offenen, parallel kontrollierten, nicht minderwertig gestalteten, multizentrischen klinischen Phase-3-Studie, die darauf abzielt, die Zweitlinienbehandlung von Paclitaxel-Lösung zum Einnehmen RMX3001 und RMX3001 zu vergleichen Paclitaxel-Injektion (Taxol) Wirksamkeit und Sicherheit bei Patienten mit fortgeschrittenem Magenkrebs.Die Studie wurde gemeinsam von Professor Li Jin vom Shanghai Oriental Hospital und Professor Qin Shukui vom Nanjing Jinling Hospital als Hauptforschern durchgeführt.
Dr. Ruiping Dong, Chief Executive Officer von Haihe Pharmaceuticals, sagte: „Die Annahme des Antrags für Paclitaxel-Lösung zum Einnehmen (RMX3001) ist ein weiterer wichtiger Meilenstein für Haihe Pharmaceuticals, und ich bin den klinischen Prüfärzten und Patienten, die an unserem Antrag teilgenommen haben, sehr dankbar.“ Versuch.Fortgeschrittener Magenkrebs Es besteht immer noch ein großer ungedeckter klinischer Behandlungsbedarf und wir hoffen, Patienten in China und auf der ganzen Welt so bald wie möglich die weltweit modernsten, innovativen und bequemsten Behandlungen anbieten zu können.“
Yunnan Hande Biotechnology Co., Ltd. konzentriert sich seit 28 Jahren auf die Produktion von Paclitaxel.Es ist der weltweit erste unabhängige Hersteller des pflanzlichen Krebsmedikaments Paclitaxel, das von der US-amerikanischen FDA, dem europäischen EDQM, der australischen TGA, der chinesischen CFDA, Indien, Japan und anderen nationalen Aufsichtsbehörden zugelassen wurde.Unternehmen.Wenn Sie kaufen möchtenPaclitaxel-API,Bitte kontaktieren Sie uns online.
Zeitpunkt der Veröffentlichung: 14.09.2022